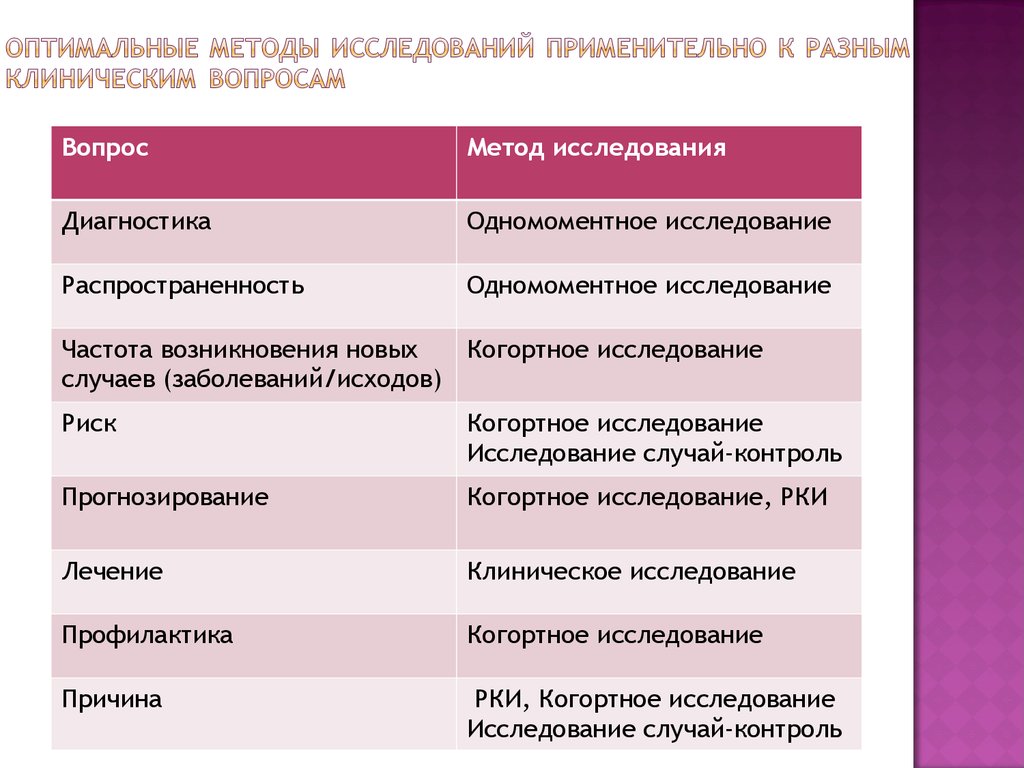
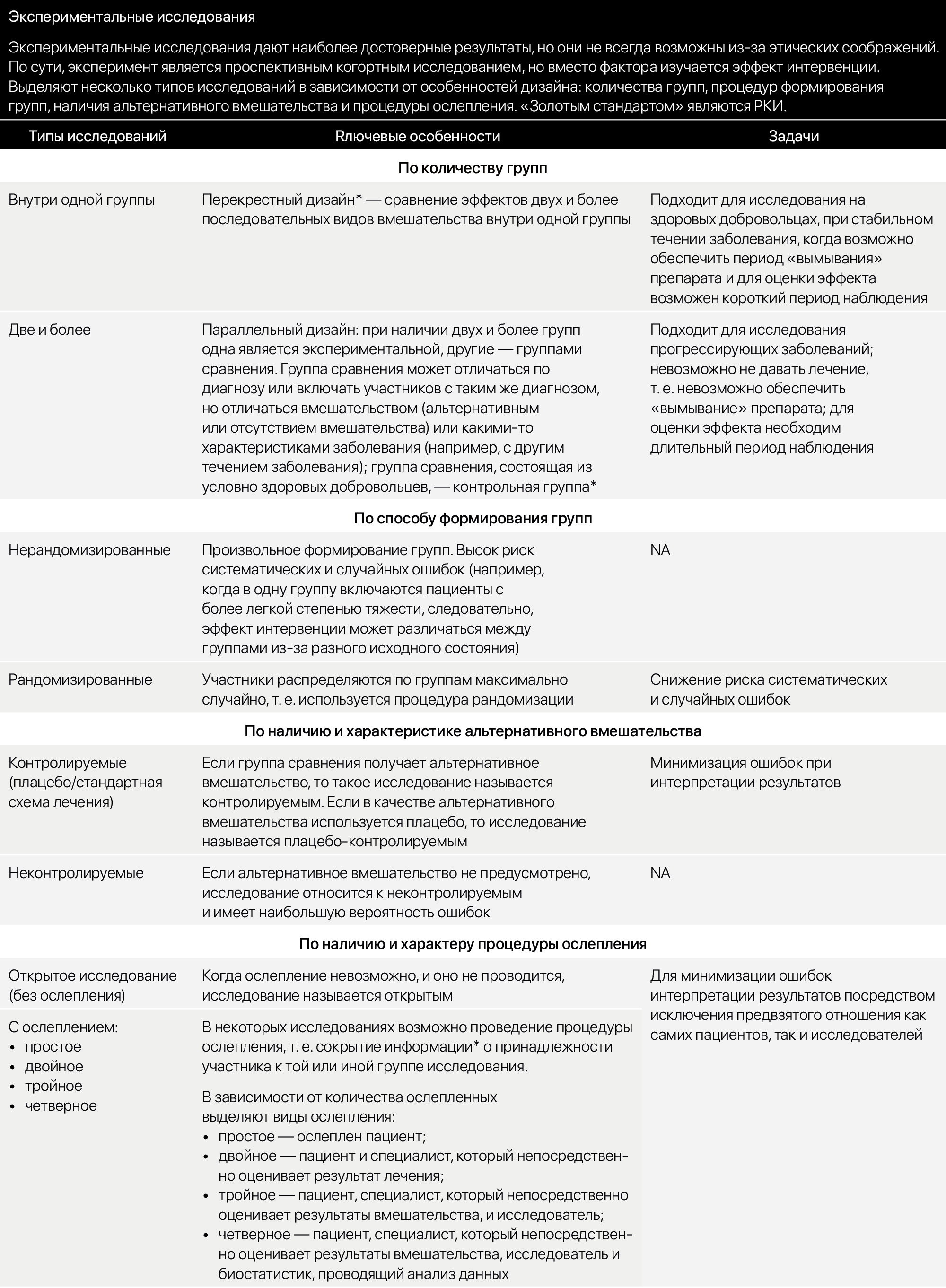
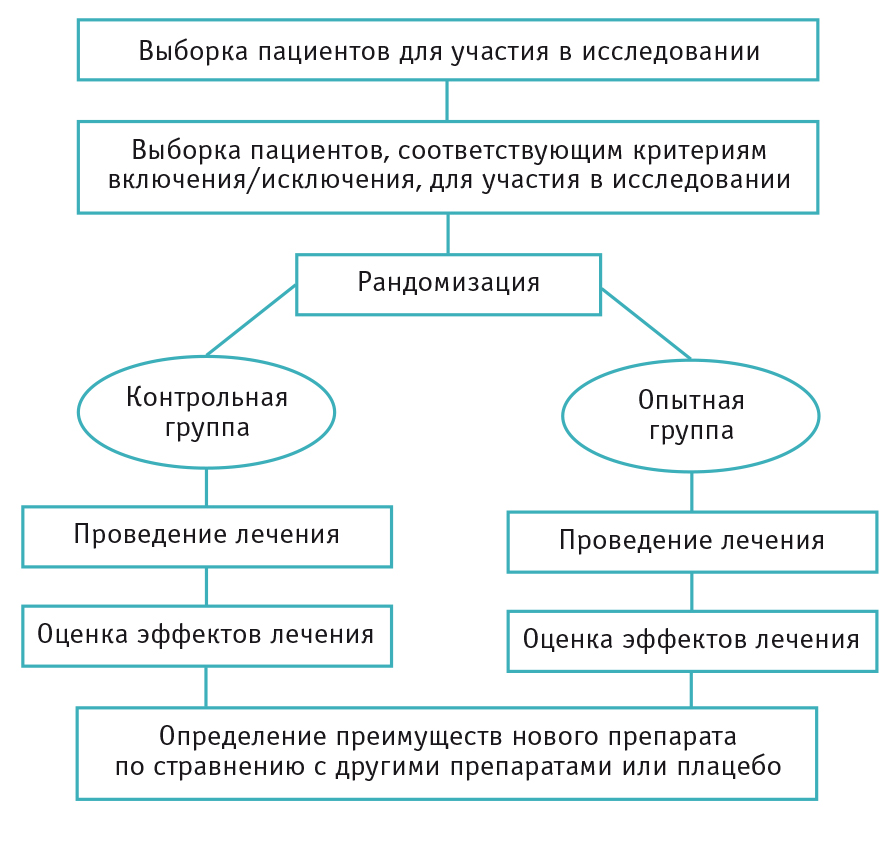
Виды дизайнов клинических исследований

Дизайн клинических исследований с участием человека
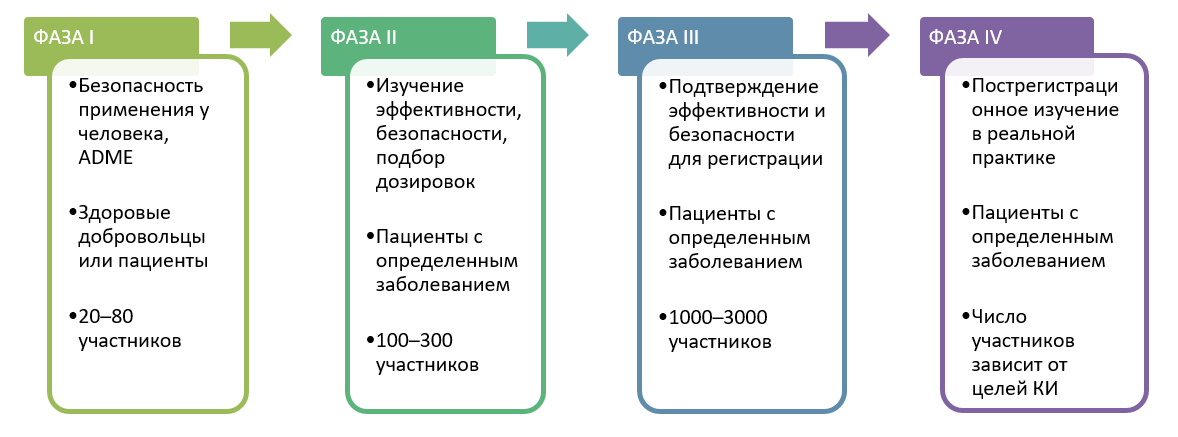
Ассоциация организаций по клиническим исследованиям AOKИ — некоммерческая организация, объединяющая юридических лиц, участников российского рынка клинических исследований. Скачать в формате. Малая Пироговская, д. Проведение клинических исследований у детей — трудоемкая задача как для организаторов, так и для педиатров-исследователей. Сложность набора пациентов, значительная гетерогенность популяции, специфические побочные реакции, затруднения в определении объективных конечных показателей обусловливают специфичность дизайна клинических исследований в педиатрии.









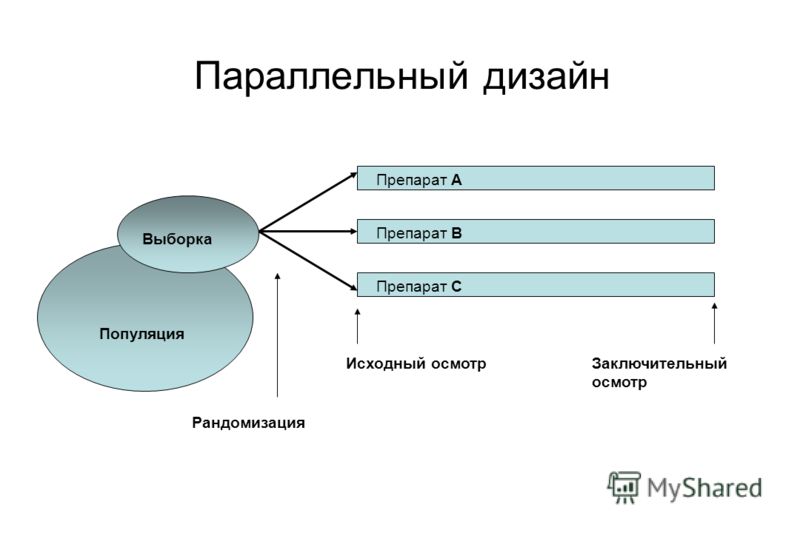
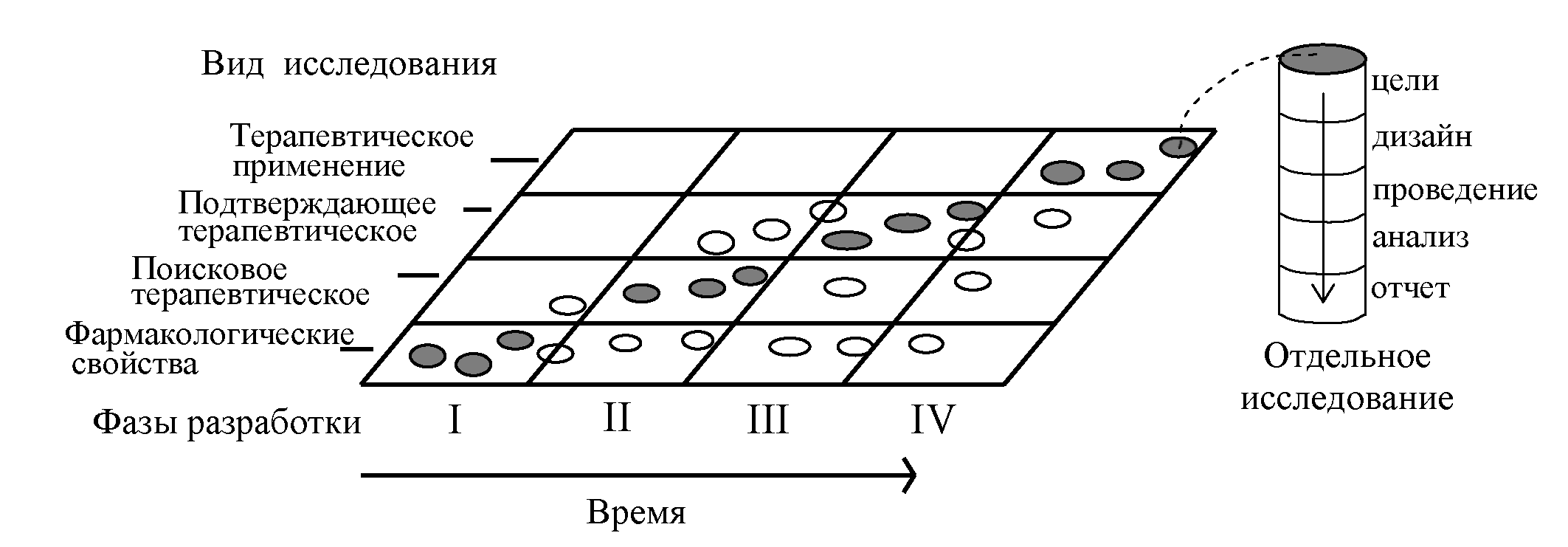

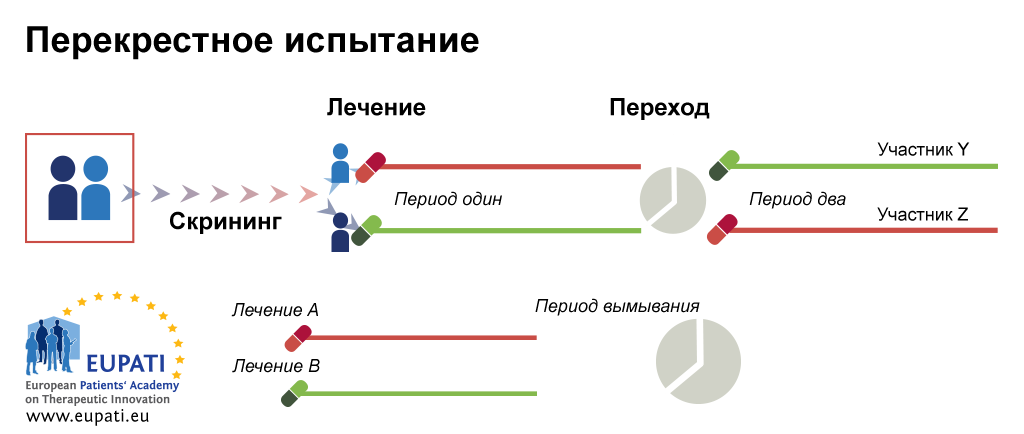
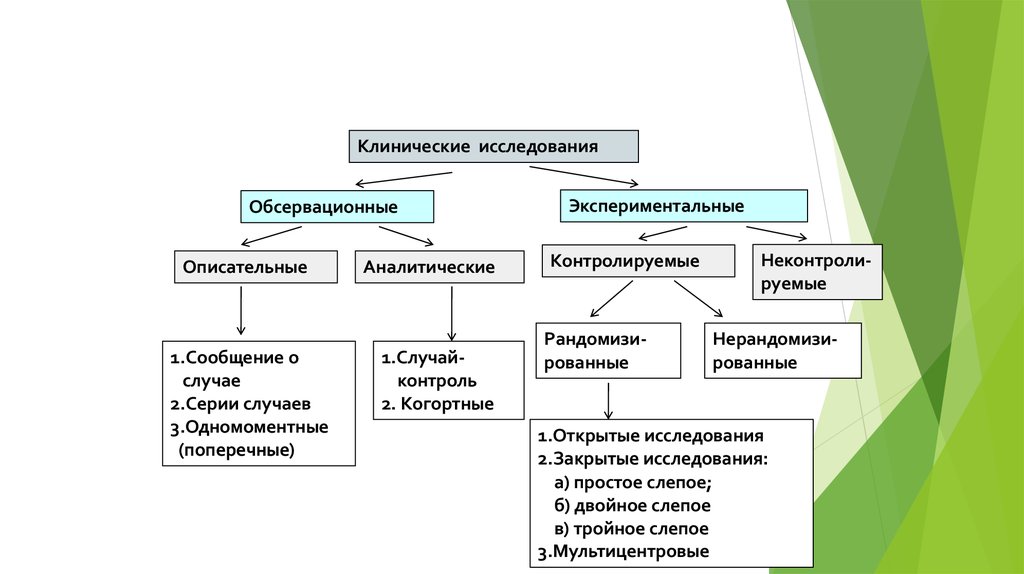
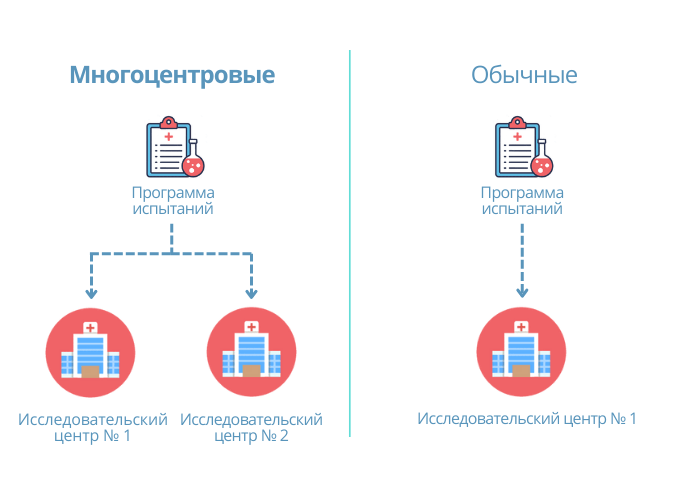
Рассмотрим основные критерии, по которым строится дизайн, и какие в зависимости от этого бывают виды клинических исследований КИ. Основные особенности дизайна КИ, как правило, указаны в разделе «Материалы и методы» публикации с его результатами. Медицинская статистика стала неотъемлемой частью клинической практики , поэтому каждому врачу важно разбираться в ней. Этот материал доступен только после авторизации. Войдите или зарегистрируйтесь, чтобы получить доступ ко всем материалам сайта.




Данная версия статьи — промежуточная и может измениться при доработке. Существенная часть успеха проведения исследований биоэквивалентности определяется в момент планирования и разработки протокола исследования. При определении дизайна исследования не всегда проводится широкое обсуждение, которое может ограничиваться выбором дизайна на основании общих соображений без рассмотрения всех аспектов потенциально влияющих на выбор. Далее постараемся подробно разобрать возможные подходы к разработке протокола клинического исследования биоэквивалентности.